
聯係亚洲线精品一区二区三区八戒
電話:
021-66126658
021-66126659
盧總:
139-1700-9455
昆山電話:
0512-5759 1865
郵箱:
sy.lu@cy-water.com
地址:上海市普陀區曹楊路1700號辰金高尚領域T9幢308室
國內外監管機構對製藥用水質量控製的要點分析
製藥用水廣泛用於藥品生產過程和藥物製劑的製備,同時也被用作溶劑、衝洗劑等。製藥用水的質量直接影響藥品的質量,與藥品的安全息息相關。概述分析了中國、美國和歐盟製藥用水的管理、質量控製要求及其差異,同時探討了製藥用水分類、注射用水製法及製藥用水微生物控製,為國內製藥用水相關技術標準建設及科學監管提供參考。
製藥用水是藥物生產中用量大、使用廣的一種輔料,廣泛用於藥品生產過程和藥物製劑的製備, 同時也被用作溶劑、衝洗劑等。製藥用水的質量直接影響藥品的質量,美國食品藥品監督管理局(FDA)曾發布多起因製藥用水微生物汙染等導致的藥品召回事件或者警告信。目前,國內外主要藥典均規定了製藥用水的質量標準及相關要求,但各國對製藥用水的分類、製備方法及質量控製要求存在差異。本文匯總概括了中國、美國和歐洲製藥用水的管理和技術要求,並對其分類及質量控製的關鍵點進行了對比分析,為國內製藥用水相關技術標準建設及科學監管提供參考。
01、國內外製藥用水的分類及相關規定
《中國藥典》2000 年版(ChP 2000)首次收載製藥用水,ChP 2020規定製藥用水依其使用的範圍不同分為飲用水、純化水、注射用水和滅菌注射用水。一般應根據各生產工序或使用目的與要求選用適宜的製藥用水。藥品生產企業應確保製藥用水的質量符合預期用途的要求。
製藥用水至少應符合飲用水的要求。飲用水為天然水經淨化處理所得的水,其質量必須符合現行中華人民共和國國家標準《生活飲用水衛生標 準》。純化水為飲用水經蒸餾法、離子交換法、反滲透法或其他適宜方法製備的製藥用水,其質量應符合純化水項下的規定。純化水不得用於注射劑的配製與稀釋。注射用水為純化水經蒸餾所得,應符合《中國藥典》(ChP)細菌內毒素試驗要求。注射用水必須在防止細菌內毒素產生的條件下生產、貯藏及分裝,其質量應符合 ChP 注射用水項下的規定。滅菌注射用水為注射用水按照注射劑生產工藝製備所得,臨床上主要用於衝洗劑、注射劑配製的溶劑或稀釋劑,其質量應符合ChP滅菌注射用水項下的規定。
中國《藥品生產質量管理規範》(GMP)2010 年修訂版對製藥用水的質量控製,製藥用水係統的設計、安裝、運行和維護以及製藥用水的製備、貯存和分配等均有嚴格的規定及要求。同時明確製藥用水應當適合其用途的規定,並符合 ChP的質量標準及相關要求,同時明確製藥用水至少為純化水。純化水、注射用水的製備、貯存和分配應當能夠防止微生物的滋生,純化水可采用循環,注射用水可采用70 ℃以上保溫循環等。
《美國藥典》(USP)第1版收載了純化水與注射用水,USP第23版增加了純化水和注射用水電導率和總有機碳(TOC)的測定 ,2018 年修訂版 USP< 1231>製藥用水正式生效。現行的第 2022 年版《美國藥典》(USP 2022)收載的通則<1231>製藥用水包 括散裝水(bulk waters)、包裝水(sterile waters,無菌水)等,散裝水包括純化水(purified water)、注射用水(water for injection)、透析用水(water for hemodialysis)及純蒸汽(pure steam);包裝水包括滅菌純化水(sterile purified water)、滅菌注射用水(sterile water for injection)、抑菌注射用水(bacteriosestatic water for injection)、滅菌衝洗用水(sterile water for irrigation)、滅菌吸入用水(sterile water for inhalation);另外還包括其他類型的無氨水、無二氧化碳水、去離子水等。用於生產純化水的最低質量水源為符合美國環保署、歐盟(EU)、日本或世界衛生組織(WHO)的飲用水,純化水可通過去離子法、蒸餾法、離子交換法、反滲透法、過濾法等技術進行製備。注射用水是通過蒸餾法或采用 等同或優於蒸餾法的方法進行製備。
美國現行藥品生產質量管理規範(cGMP)沒有直接規定製藥用水的相關要求,但對製藥用水係統提出了要求(如要求管道材質為316 L不鏽鋼、靜止保存 24 h內使用等),同時明確生產無菌藥品時,最後衝洗用水的質量要達到注射用水的標準等。
《歐洲藥典》(EP)最早於 1969 年收載純化水,1979年首次收錄注射用水,2017年生效了等同蒸餾技術的方法用於注射用水的製備,2019年刪除了高純水並新增提取用水。現行版 EP(EP 10.6)製藥用水包括純化水、注射用水、提取用水。純化水為飲用水經蒸餾法、離子交換法、反滲透法或其他適宜的方法進行製備,注射用水由純化水經蒸餾法、反滲透法、超濾法、納濾法、電去離子等方法製備得到的製藥用水。純化水分為散裝純化水(purified water in bulk)和 包裝純化水(purified water in containers)。注射用水包括散裝注射用水(water for injections in bulk)、滅菌注射用水(sterilised water for injections)。EP 明確要求如果散裝純化水的電導率檢測結果不符合規定要求,應開展元素雜質風險評估。
EU 於 2021 年發布了更新的《製藥用水質量指南》,該指南用以指導人用、獸用製劑和原料生產時製藥用水的選擇,幫助申請人在申報藥品上市及補充申請時準確選擇製藥用水的級別等。指南明確要求製藥用水要滿足EP的要求,對製藥用水的純化、貯存係統進行驗證要求等,同時分別明確原料藥生產、製劑、清潔或淋洗等的可接受最低水質要求,其中製劑製粒、片劑包衣和非無菌凍幹前配方可接受使用的最低水質為純化水,而無菌凍幹前配方使用的最低水質應為注射用水。
此外,EU《藥品生產質量管理規範》(EU GMP)明確了製藥用水的製備、貯存和分配等相關要求,新修訂的“附錄1”<無菌產品生產>還明確了注射用水係統應裝備監測 TOC 和電導率等的連續監測係統,並要求作為直接滅菌用的蒸汽應符合相應要求。
02、製藥用水質量控製要求
2.1 國內外藥典製藥用水質量控製一般要求
ChP、USP和 EP均規定了製藥用水的質量控製一般要求,散裝純化水、注射用水控製要求匯總見表1。對比分析顯示ChP較EP、USP對硝酸鹽、亞硝酸鹽、不揮發物、重金屬等控製項進行檢查;另外,EP 明確如散裝純化水電導率不符合要求,應進行元素雜質評估,如用於透析液的製備還需檢測鋁元素和細菌內毒素。與 EP、USP 比較,ChP 注射用水對酸堿度、氨、亞硝酸鹽、不揮發物、重金屬等控製項進行檢測,EP明確用於製備透析液的散裝注射用水應檢測鋁元素。ChP、USP、EP均規定純化水中微生物每毫升不得過 100 cfu,注射用水每 100 毫升 不得過10 cfu。
表 1 各國藥典純化水和注射用水的質控項對比
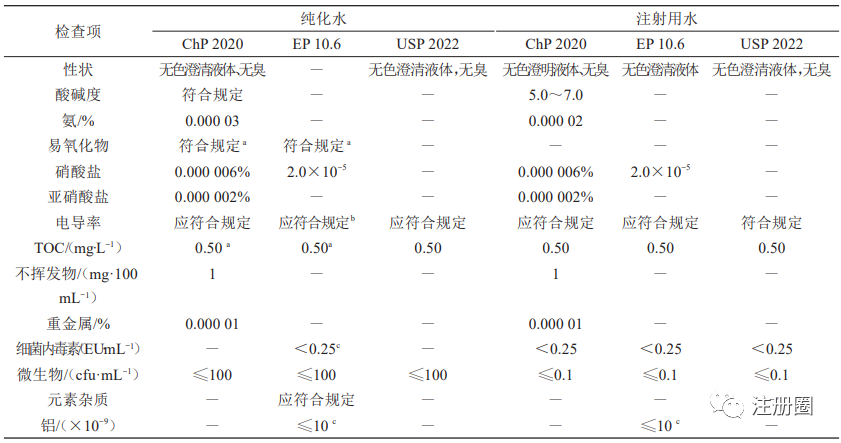
a-TOC和易氧化物檢測兩項選一;b-電導率如不符合要求需要進行元素雜質評估;c-用於製備透析液
2.2 製藥用水關鍵質控項
2.2.1電導率
電導率是表征物體導電能力的物理量,其值為物體電阻率的倒數,單位是S·cm−1 或 μS·cm−1。電導率是製藥用水的關鍵質量屬性,其與製藥用水的純度密切相關,純度越髙電導率越小。電導率可快速監測製藥用水中電解質的總量,可反映水中氯化物、硫酸鹽、鈣鹽、氨及二氧化碳等無機電解質含量。因此,各國藥典對製藥用水電導率均有明確規定,對於純化水,ChP 電導率控製要求與 EP 基本一 致,較 USP 寬鬆 ,在 25 ℃條件下 ChP 和 EP 電導率限度均為≤5.1 μS·cm−(1 25 ℃),而 USP 嚴格 為 ≤1.3 μS·cm−1 ;對於注射用水,ChP 電導率控製限度與 USP、EP 一致 ,在 25 ℃ 條 件 下,限度均為≤1.3 μS·cm−1。
ChP、USP、EP均收載了製藥用水電導率測定方法,大多采用水-電解質二元混合體係的分析和總電解質濃度的測定,該檢測方法快速、精確且操作簡單,能在線實時監測水處理係統的工作情況。另外,要注意電導率與製藥用水的 pH 值和溫度有關, 尤其溫度對電導率測定值有較大影響,由於采用溫度修正補償方法所得結果誤差較大,因此通常采用非溫度補償模式,基於實際溫度或調節至指定溫度(如ChP規定滅菌注射用水調節至25 ℃),根據測得的電導率值與溫度(或 pH值)對應的電導率限度規定值比較判斷測定結論。
TOC是表征製藥用水中有機汙染物含量的指標,TOC和電導率已成為水質量控製且能快 速監測的重要指標 。相較於化學需氧量(CODCr)、5 日生化需氧量(BOD5)等方法,TOC 更能準確、直接和全麵反映水中總有機物的含量。製藥用水中的有機物質主要來自水源 、供水係統(包括淨化、貯存和輸送係統)以及水係統中菌膜的生長。較低水平的 TOC 值意味著水中有機物、微生物及細菌內毒素汙染受到良好的控製。現行 USP、ChP 與 EP 對 TOC 的控製限度均為0.50 mg·L−1。
ChP、USP、EP 均收載了製藥用水 TOC 測定方法,有多種方法可用於測定 TOC,通常應要求 TOC 測定技術能區分無機碳(如水中的二氧化碳)和有機碳,能排除無機碳對測定的幹擾,同時應滿足係統適用性試驗的要求。
2.2.3 微生物
製藥用水在製備、儲存和使用過程,易被微生物汙染,微生物及其代謝產物會嚴重影響藥品安全性,且水係統又比較複雜,因此製藥用水必須基於風險管理理念,同時製定定期的微生物檢測控製策略,以確保製藥用水及產品的質量。需要注意的是水係統未保護的通氣口、有缺陷的空氣過濾器、破損的安全隔膜、經過未消毒的管道、未及時更換的活性炭、離子樹脂(尤其是未及時更換)及再生化學試劑等易引起製藥用水的微生物汙染。
ChP、USP與 EP製藥用水微生物控製方法上存在較大差異,主要差異為培養基和檢查方法。對於純化水 ChP 與 EP 均采用薄膜過濾法,而 USP 在推薦薄膜過濾法基礎上,還允許采用平皿法用於微生物限度檢查;注射用水各藥典均將薄膜過濾法作為唯一的檢查方法。R2A 瓊脂培養基用於 ChP 純化水和注射用水的微生物限度檢查。USP通則<1231>製藥用水沒有指定微生物限度檢查用培養基和培養時間,明確了樣品采集後盡快進行檢測,如果無法在采集 2 h檢測,樣品應在冷藏(2~8 ℃)下保存,並在 24 h內進行檢測。EP 則規定散裝純化水微生物檢測采用R2A瓊脂培養基,包裝純化水微生物培養采用胰酪大豆腖瓊脂培養基。
03、國內外製藥用水監管差異對中國的啟示
3.1 製藥用水種類
現行 USP 收載的製藥用水分類最多,不僅包括常規的純化水、注射用水,還包括透析用水、純蒸汽、滅菌吸入用水、無二氧化碳水、無氨水等。ChP 收載的製藥用水種類較少,覆蓋麵較窄,這給臨床用藥安全帶來了較大風險,也難以適應行業發展,同時不利於科學監管。比如對於使用量較大的透析用水或透析液製備用水,USP收載了透析用水,並在現行通則<1230>基礎上進一步規定了電導率、TOC、細菌內毒素(1 EU·mL−1 )、微生物限度等控製要求;EP 也對用於製備透析液的純化水和注射用水提出了細菌內毒素和鋁元素等嚴格控製的要求。而 ChP 未收載透析用水,也未明確相關的質控要求,臨床使用的透析用水執行《血液透析及相關治療用水》行業標準(YY0572-2015),其規定了血液透析、血液透析濾過和在線血液濾過或在線血液透析濾過中製備 透析濃縮液和透析液及血液透析器再處理所用水的最低要求,但未收入 TOC 控製,同時國內對於用於製備血濾置換液、腹膜透析液等品種的用水,通常沒有對鋁元素等進行針對性控製。
3.2 注射用水製法
ChP限定注射用水製法隻能是蒸餾法,這與 USP、EP 中注射用水製法存在較大差異。USP、EP 以及日本藥典(JP 18)都可由蒸餾法與非蒸餾法製備注射用水,允許使用等同或高於蒸餾技術的純化工藝,采用反滲透、超濾組合適當的其他膜分離等技術用於製備注射用水;同時,近年 WHO、國際製藥工程協會(ISPE)也發布了《非蒸餾法製備注射用水》技術報告 ,詳細介紹和討論了注射用水非蒸餾製法。膜分離技術是一種成熟的並已經在醫藥行業廣泛認可和應用的純化技術,其用於注射用水製備在歐美日已有實踐經驗,同時在經濟性和生態環保方麵具有明顯的優勢,有利於提高原水利用率和節能減排。國內外注射用水製法存在的差異,這給藥品國際化生產和監管帶來了極大的挑戰,有必要對注射用水非蒸餾製法的必要性、技術難點、風險點和可行性等進行分析和探討。
由於膜結構複雜以及膜分離技術通常在常溫下運行,因此對於膜法製備注射用水的原水和生產過程的微生物和內毒素質量監控尤為重要。EP 要求設計階段應盡可能考慮減少微生物汙染和滋生的風險,同時基於風險分析製定更為謹慎的控製策略確保微生物和內毒素的低風險並長期持續保持,如應配置快速微生物和內毒素質量檢測技術作為整體控製策略的一部分,另外還要關注含氯等消毒劑對膜材的影響等。考慮膜技術存在的風險和生產商有限的實踐經驗,EP還要求生產商在非蒸餾法實施之前要通知監管當局。
3.3 微生物的控製
微生物限度結果易受檢查方法、方法靈敏度、汙染菌檢出率和培養體係等影響。ChP製藥用水微 生物檢查方法、培養條件等與USP、EP存在不同,可能造成檢查結果存在差異。ChP 與 EP 均規定采用薄膜過濾法作為純化水微生物限度檢查方法,USP 純化水檢驗時列舉推薦了薄膜過濾法和平皿法。已有文獻對比了兩種微生物檢測方法,薄膜過濾法相比平皿法更易於去除樣本中的抑菌成分,同時薄膜過濾法可以檢測更大的樣本量更適合低汙染水平的水係統,以保證所得到的數據更具有統計學意義;而平皿法具有費用低,檢測方法較簡便,微生物汙染水平較高的水係統采用平皿法可得到更為準確的數據。ChP明確純化水和注射用水微生物限度檢查采用 R2A 瓊脂培養基,而 EP 規定根據不同 水樣采用 R2A 瓊脂培養基和胰酪大豆腖瓊脂,USP 則沒有明確培養基種類。R2A 瓊脂培養基和胰酪大豆腖瓊脂兩種培養基的主要區別為 R2A 更適用於支持耐受氯氣的微生物生長,屬於低營養的培養基,而胰酪大豆腖瓊脂用於營養要求較高的細菌培養。USP 沒有簡單規定製藥用水微生物汙染控製方法,其控製思路是基於不同水係統以及不同階段 的微生物種類、數量等特征選擇適宜的微生物檢查方法、樣本量和培養條件,是指導性標準,有利於藥品生產商建立適宜自身水係統的微生物控製策略。鑒於檢查方法、培養條件等對製藥用水微生物控製的直接影響以及國內外存在的差異,有必要對我國製藥用水微生物限度檢查和控製策略開展更加細化的研究。
另外用於非無菌水性基質藥品生產的製藥用水,還需根據產品特有要素、生產要素,進行不可接受微生物洋蔥伯克霍爾德菌群汙染的風險評估,對洋蔥伯克霍爾德菌群進行研究和檢查,製定合理有效的控製策略。
製藥用水直接影響藥品的安全,國內外都非常重視製藥用水的質量控製和監管。伴隨醫藥行業發展和中國藥品監管的國際化進程,需要豐富國內製藥用水分類、完善注射用水製備工藝和優化製藥用水的微生物限度等項目控製,進一步健全我國製藥用水標準體係,推進科學監管,保障藥品質量,同時滿足藥品國際化生產需求和促進國際化監管。製藥企業應高度重視製藥用水質量控製的重要性,關注不同用途的製藥用水質量控製的差異,依據藥 品及工藝要求選擇相應的製藥用水,並製定規範的製藥用水內控標準和適宜的質量控製策略,以持續保障藥品安全。
上一個: 注射水設備的工藝流程
下一個: 生物製藥行業超純水淨化處理裝置


